Volume
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
olume atau bisa juga disebut kapasitas adalah penghitungan seberapa banyak ruang yang bisa ditempati dalam suatu objek. Objek itu bisa berupa benda yang beraturan ataupun benda yang tidak beraturan. Benda yang beraturan misalnyakubus, balok, silinder, limas, kerucut, dan bola. Benda yang tidak beraturan misalnya batu yang ditemukan di jalan. Volume digunakan untuk menentukan massa jenis suatu benda.
Rumus volume[sunting | sunting sumber]
| Bentuk | Rumus volume | Variabel |
|---|---|---|
| Kubus |  | a = panjang sisi/rusuk |
| Silinder | 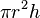 | r = jari-jari alas, h = tinggi |
| Prisma | 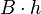 | B = luas alas, h = tinggi |
| Balok |  | l = panjang, w = lebar, h = tinggi |
| Prisma segitiga |  | b = panjang dasar segitiga, h = tinggi prisma, l = length of prism or distance between the triangular bases |
| Bola |  | r = jari-jari bola dimana merupakan integral luas permukaan bola |
| Ellipsoid |  | a, b, c = semi-axes of ellipsoid |
| Torus |  | r = jari-jari kecil, R = jari-jari besar |
| Limas |  | B = luas alas, h = tinggi limas |
| Limas persegi |  | s = sisi samping alas limas, h = tinggi |
| Limas segiempat |  | l = panjang, w = lebar, h = tinggi |
| Kerucut |  | r = jari-jari lingkaran di dasar kerucut, h = jarak dari dasar ke pucuk atau tinggi |
| Tetrahedron[1] |  | panjang sisi 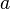 |
| Parallelepiped | 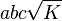 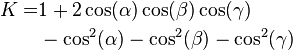 | a, b, and c are the parallelepiped edge lengths, and α, β, and γ are the internal angles between the edges |
| Volume benda putar (dibutuhkankalkulus) |  | h = dimensi apapun, A(h) = luasan cross-section tegak lurus terhadap hyang didefinisikan sebagai fungsi posisi sepanjang h. adan b adalah batas integrasi volume putar. (Berlaku untuk semua bangun jika cross-sectional areanya dapat ditentukan dari h). |
| Semua benda diputar (dibutuhkankalkulus) | ![\pi \int_a^b \left({\left[R_O(x)\right]}^2 - {\left[R_I(x)\right]}^2\right) \mathrm{d}x](https://upload.wikimedia.org/math/d/e/5/de54e46b539494ba235ee16fb93b6cc2.png) |  dan dan  menyatakan fungsi dari jari-jari luar dan jari-jari dalam fungsi, secara berurutan. menyatakan fungsi dari jari-jari luar dan jari-jari dalam fungsi, secara berurutan. |
Rasio volume untuk kerucut, bola, dan silinder dengan tinggi dan jari-jari sama[sunting | sunting sumber]
Rumus diatas dapat digunakan untuk menunjukkan bahwa volume kerucut, bola, dan silinder dengan jari-jari dan tinggi sama memiliki rasio 1 : 2 : 3, seperti berikut ini.
Besar jari-jari dianggap r dan tinggi dianggap h (menjadi 2runtuk bola), maka volume kerucut
volume bola
sedangkan volume silinder
Penemuan rasio volume bola dan silinder 2 : 3 ditemukan oleh Archimedes.[2]
Volume dalam kalkulus[sunting | sunting sumber]
Pada kalkulus, volume dari sebuah region D dalam R3 adalah integral rangkap tiga dari fungsi konstanta  dan biasanya dituliskan sebagai:
dan biasanya dituliskan sebagai:
 dan biasanya dituliskan sebagai:
dan biasanya dituliskan sebagai:
Integral volume pada koordinat silinder adalah
dan integral volume dalam koordinat bola dituliskan sebagai
Satuan volume[sunting | sunting sumber]
- 1 m3 = 103 dm3 = 106 cm3
- 1 dm3 = 1 l
- 1 cm3 = 1 ml = 1 cc
Volume dalam termodinamika[sunting | sunting sumber]
Dalam termodinamika, volume dari sebuah sistem termodinamika adalah suatu parameter ekstensif untuk menjelaskankeadaan termodinamika. Volume spesifik, adalah properti intensif, adalah volume per satuan massa. Volume merupakanfungsi keadaan dan interdependen dengan properti termodinamika lainnya seperti tekanan dan suhu. Contohnya, volume berhubungan tekanan dan suhu gas ideal melalui hukum gas ideal.
Referensi[sunting | sunting sumber]
- ^ Coxeter, H. S. M.: Regular Polytopes (Methuen and Co., 1948). Table I(i).
- ^ Rorres, Chris. "Tomb of Archimedes: Sources". Courant Institute of Mathematical Sciences. Diakses 2007-01-02.
Untuk mngetahui lebih jauh tentang Artikel Volume dalam Termodinamika ini
"KLIK LINK DIBAWAH INI"












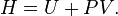
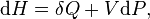



 adalah
adalah  adalah
adalah 


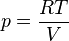 →
→ =
= 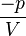
 →
→
 =
= 



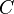 adalah kapasitas panas
adalah kapasitas panas adalah massa zat
adalah massa zat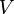 volume zat
volume zat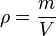 massa jenis zat
massa jenis zat ) dan
) dan ). Hubungan panas jenisnya dapat dirumuskan dengan:
). Hubungan panas jenisnya dapat dirumuskan dengan:

