Jumat, 20 Maret 2015
Pemuaian Panas (Kalor)
Gas Nyata
- Gas nyata – kebalikan dari gas ideal - menjelaskan karakteristik yang tidak dapat dijelaskan oleh hukum gas ideal. Untuk memahami perilaku gas nyata, maka faktor-faktor berikut ini mesti diperhitungkan:
- efek kompresibilitas;
- kapasitas panas spesifik;
- Gaya van der Waals;
- efek termodinamika tidak setimbang;
- disosiasi molekul
Di banyak perhitungan, analisis mendetail mengenai gas nyata jarang dipergunakan, dan perkiraan dari nilai gas ideal dapat digunakan. Di sisi lain, model gas ideal dapat digunakan digunakan pada kondisi mendekat titikkondensasi gas, mendekati termodinamika, pada tekanan sangat tinggi, dan untuk menjelaskan efek Joule-Thomson serta beberapa kasus lain yang jarang digunakan. Model van der Waals
Gas nyata diperhitungan dari massa molar dan volume molarP adalah tekanan, T adalah temperatur, R adalah konstanta gas ideal, serta Vm adalah volume molar. a dan b adalah konstanta yang didefinisikan secara empiris untuk tiap gas, namun terkadang nilainya dapat diperkirakan dari nilaitemperatur kritis (Tc) dan tekanan kritis (Pc) menggunakan hubungan:- untuk lebih jelasnya "KLIK LINK DIBAWAH INI"
- http://id.wikipedia.org/wiki/Gas_nyata
Eksotermi
Eksotermik
Eksotermik ("pemanasan luar") dalam kaidah pembahasan termodinamikamenjelaskan suatu proses atau reaksi yang melepaskan energi panas atauenergi cahaya (contohnya percikan api atau ledakan), energi listrik (contohnya pada baterai), atau bisa juga energi suara. Asal kata eksotermik adalah dariawalan kata bahasa Yunani "ex-" (yang berarti di luar) dan "thermein" (yang berarti panas). Istilah ini pertama kali dicetuskan oleh Marcellin Berthelot, seorang ahli kimia dari Perancis. Kebalikan dari proses eksotermik adalah proses endotermik, yang menyerap energi dalam bentuk panas.
Konsep ini sering diterapkan dalam ilmu fisika untuk suatu reaksi kimia, di mana energi ikatan kimia diubah bentuknya menjadi energi panas (bahasa Inggris: thermal).
Contoh
Beberapa contoh dari sebuah reaksi eksotermik dalam kehidupan sehari-hari adalah [1]:
- Proses pengembunan (kondensasi) uap air menjadi hujan.
- Proses pembakaran bahan bakar seperti kayu, batubara dan minyak.
- Proses pencampuran air dengan asam kuat (bahasa Inggris: strong acid).
- Proses pencampuran alkali dengan asam.
- Beberapa reaksi polimer, seperti proses pencampuran lem besi (Plastic Steel) (bahasa Inggris: epoxy resin).
- Adukan semen
- Reaksi termit.
Kondensasi
Kondensasi atau pengembunan adalah perubahan wujud benda ke wujud yang lebih padat, seperti gas (atau uap) menjadi cairan. Kondensasi terjadi ketika uap didinginkan menjadi cairan, tetapi dapat juga terjadi bila sebuah uap dikompresi (yaitu, tekanan ditingkatkan) menjadi cairan, atau mengalami kombinasi dari pendinginan dan kompresi. Cairan yang telah terkondensasi dari uap disebutkondensat. Sebuah alat yang digunakan untuk mengkondensasi uap menjadi cairan disebut kondenser. Kondenser umumnya adalah sebuah pendingin ataupenukar panas yang digunakan untuk berbagai tujuan, memiliki rancangan yang bervariasi, dan banyak ukurannya dari yang dapat digenggam sampai yang sangat besar.
Kondensasi uap menjadi cairan adalah lawan dari penguapan (evaporasi) dan merupakan proses eksothermik (melepas panas). Air yang terlihat di luar gelas air yang dingin di hari yang panas adalah kondensasi.
Kondensasi air
Uap air di udara yang terkondensasi secara alami pada permukaan yang dingin dinamakan embun. Uap air hanya akan terkondensasi pada suatu permukaan ketika permukaan tersebut lebih dingin dari titik embunnya, atau uap air telah mencapai kesetimbangan di udara, seperti kelembapan jenuh. Titik embun udara adalah temperatur yang harus dicapai agar mulai terjadi kondensasi di udara.
Molekul air mengambil sebagian panas dari udara. Akibatnya, temperatur atmosfer akan sedikit turun. Di atmosfer, kondensasi uap airlah yang menyebabkan terjadinya awan. Molekul kecil air dalam jumlah banyak akan menjadi butiran air karena pengaruh suhu, dan tapat turun ke bumi menjadi hujan. Inilah yang disebut siklus air. [1]
Pengendapan atau sublimasi juga merupakan salah satu bentuk kondensasi. Pengendapan adalah pembentukan langsunges dari uap air, contohnya salju.
| Dari | Ke | |||
| Padat | Cair | Gas | Plasma | |
|---|---|---|---|---|
| Padat | N/A | Mencair | Menyublim | - |
| Cair | Membeku | N/A | Menguap | - |
| Gas | Mengkristal | Mengembun | N/A | Ionisasi |
| Plasma | - | - | Rekombinasi/Deionisasi | N/A |
Endotermik
Endotermik ("pemanasan dalam") dalam kaidah pembahasan termodinamika menggambarkan suatu proses atau reaksi yang menyerap panas. Asal kata eksotermik adalah dari awalan kata bahasa Yunani "endo-" (yang berarti di dalam) dan "thermein" (yang berarti panas). Kebalikan dari proses endotermik adalah proses eksotermik, yaitu proses yang melepaskan energi dalam bentuk panas. Istilah "endotermik" diciptakan oleh Marcellin Berthelot (25 Oktober 1827 - 18 Maret 1907), seorang ahli kimia dari Perancis.
Contoh[sunting | sunting sumber]
Beberapa contoh dari sebuah reaksi endotermik dalam kehidupan sehari-hari adalah [1]:
- Proses penguapan air dan fotosintesis.
- Sebungkus es kimia (bahasa Inggris: chemical ice pack), untuk penghilang rasa sakit saat cedera berolahraga yang terdiri dari ammonium nitrat dan air. [2]
untuk lebih jelasnya " KLIK LINK DIBAWAH INI"
Selasa, 17 Maret 2015
Siklus Carnot dari sebuah gas ideal
Siklus Carnot dari sebuah gas ideal
Dalam problem ini, tekanan awal P dan volume awal V diketahui yaitu a. Rasio RV =V /V >1 dari volume pada keadaan c dan a juga diketahui. Konstanta γ diketahui sebesar 5/3. Anda tidak mengetahui berapa banyak mol gas yang ada.
Bacalah tahapan (1)- (4) berikut ini dan buatlah sketsa gambar untuk tiap tahapan siklusnya dalam grafik P-V. Berilah tanda pada titik-titik yang penting!
(1). Pada tahapan pertama dari keempat tahapan, anggaplah dari a ke b, sebuah gas ideal dikompresi dari Va menjadi Vbdan tidak boleh ada panas yang masuk atau keluar dari sistem. Pengompresian gas ini menyebabkan suhu gas naik dari suhu awal T1 menjadi suhu akhir T2. Selama proses ini, nilai dari PVγ= konstan, sedangkan nilai γ adalah= 5/3.
- Berapakah tekanan Pb dan volume Vb gas pada keadaan b setelah proses pengompresian selesai?
- Berapakah perubahan energi dalam gas selama proses pengompresian ini?
- Berapakah usaha yang dilakukan oleh gas dalam proses pengompresian ini?
(2). Gas ini sekarang memuai secara isotermik dari b ke c, volumenya pun berubah dari Vb menjadi Vc.
- Hitunglah usaha yang dilakukan oleh gas selama proses Wcb ini dan jumlah panas yang dihasilkan (Qcb) yang harus ditambahkan dari sumber panas pada suhu T2 dalam Pa , Va , T1 , T2 , dan Vc.
- Apakah panas ini bernilai negatif atau positif? Jelaskan apakah panas ini ditambahkan atau dikeluarkan dari sistem.
- Berapakah tekanan gas saat ini (Pc) ketika pengembangan pada tahap ini selesai?
(3). Ketika gas sekarang mencapai titik c maka sekarang gas memuai dari Vc menjadi Vd, dan tidak ada panas yang keluar atau masuk ke dalam sistem. Pemuaian gas ini menyebabkan suhu dan tekanan turun dari temperatur awal T2 menjadi suhu akhir T1 . Selama proses ini, nilai dari PVγ= konstan.
- Berapakah tekanan gas saat ini (Pd) dan volume gas sekarang (Vd) setelah gas memuai?
- Berapakah perubahan energi dalam gas selama proses ini?
- Berapakah usaha yang dilakukan gas selama proses pemuaian ini?
(4). Sekarang gas dikompresi secara isotermik dari posisi d ke a pada suhu konstan T1 dari volume Vd kembali menjadi Va.
- Berapakah usaha yang dilakukan oleh sistem ke lingkungan (Wd) dan panas yang mengalir antara sistem dan lingkungan (Qad)? Apakah besaran ini bernilai positif atau negatif? Jelaskan apakah ada panas yang masuk atau keluar dari sistem awal pada saat keadaan T1.
Siklus total:
- Berapakah total usaha (Wsiklus) yang dilakukan oleh gas selama siklus ini?
- Berapakah total panas (Qsiklus) (dari T2) dari sumber panas yang suhunya lebih tinggi selama siklus ini?
- Berapakah efisiensi siklus ini? (εmax = Wsiklus / Qsiklus ( dari T2)?
Sumber
untuk lebih jelasnya "klik link dibawah ini"
Rumus Hukum Pertama Termodinamika
Perubahan energi dalam: 
Keterangan:
:Perubahan energi dalam (Joule)
- U2:Energi dalam pada keadaan akhir (Joule)
- U1:Energi dalam pada keadaan awal (Joule)
Usaha yang dilakukan oleh gas pada tekanan tetap:
Keterangan:
- p: Besarnya tekanan (atm)
: Perubahan volume (liter)
Rumus umum usaha yang dilakukan gas: 
Penghitungan energi dalam:
- Gas monoatomik:
- Gas diatomik:
Proses-proses termodinamika gas
Proses isobarik
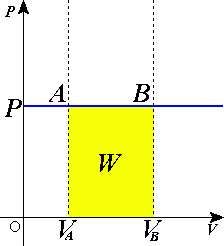
Proses isobarik adalah perubahan keadaan gas pada tekanan tetap.
Persamaan keadaan isobarik: 
Usaha yang dilakukan pada keadaan isobarik: 
Proses isokhorik
Proses isokhorik adalah perubahan keadaan gas pada volume tetap.
Persamaan keadaan isokhorik: 
Proses isotermis/isotermik
Proses isotermik adalah perubahan keadaan gas pada suhu tetap.
Persamaan keadaan isotermik: 
Usaha yang dilakukan pada keadaan isotermik:
- Dari persamaan gas ideal
- Rumus umum usaha yang dilakukan gas:
maka: 
karena  bernilai tetap, maka:
bernilai tetap, maka:
Ingat integral ini!

maka persamaan di atas menjadi
maka menjadi:
Proses adiabatik
Proses adiabatik adalah perubahan keadaan gas dimana tidak ada kalor yang masuk maupun keluar dari sistem.
Persamaan keadaan adiabatik: 
Tetapan Laplace: 
karena  , maka persamaan diatas dapat juga ditulis:
, maka persamaan diatas dapat juga ditulis:
Usaha yang dilakukan pada proses adiabatik: 
Sumber
Kanginan, Marthen (2002). Fisika Untuk SMA Kelas XI Semester 2. Erlangga. ISBN 978-979-015-273-1
Untuk lebih jelasnya " KLIK LINK DIBAWAH INI"
Langganan:
Komentar (Atom)